Münsteraner Wissenschaftler finden heraus, dass das Schicksal der Zellen im frühen Embryo spontan reguliert wird
Archivmeldung vom 17.12.2007
Bitte beachten Sie, dass die Meldung den Stand der Dinge zum Zeitpunkt ihrer Veröffentlichung am 17.12.2007 wiedergibt. Eventuelle in der Zwischenzeit veränderte Sachverhalte bleiben daher unberücksichtigt.
Freigeschaltet durch Thorsten Schmitt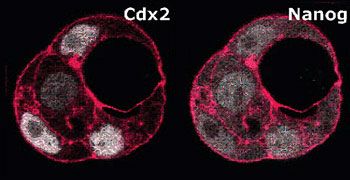
Bei Säugetieren bildet der frühe Embryo eine einzigartige Vorstruktur, die Blastozyste, die eine Einnistung in die Gebärmutter und die Versorgung des Embryos ermöglicht. Lange war unklar, ab wann die Zellen im Embryo einen spezifischen Entwicklungsweg einschlagen.
Wissenschaftler des Max-Planck-Instituts für molekulare Biomedizin in Münster
stellen in ihrer Studie in Development ein neues Modell für die frühen Abläufe
im Embryo vor. Zuerst erhalten die Zellen ihre molekulare Ausrichtung eher
zufällig, später organisieren sich die Zellen anhand ihres molekularen
Fingerabdrucks (Development, 1. Dezember 2007).
Säugetiere bestehen aus mehr als 200 verschiedenen Zelltypen, die alle ihre spezifischen Aufgaben haben. Die Zelltypen des erwachsenen Lebewesens, aber auch ein Teil der Plazenta, stammen von einer einzigen Zelle ab, der befruchteten Eizelle. Wie können sich aus einer einzigen Zelle so viele hoch spezialisierte Zellen entwickeln und zu Geweben formen? Um der Antwort auf die Spur zu kommen, beobachten Wissenschaftler, wann die ersten Unterschiede zwischen den Zellen im frühen Embryo auftauchen. Jens-Erik Dietrich und Takashi Hiiragi haben hierzu die Eigenschaften und die Position der einzelnen Zellen im frühen Embryo verfolgt.
Am dritten Tag nach der Befruchtung, nach fünf Zellteilungen, besteht ein Mausembryo aus 32 Zellen. Es hat sich zu einer kugeligen Struktur, der sogenannten Blastozyste, entwickelt, die innen hohl ist. Zu diesem Zeitpunkt gibt es bereits mindestens zwei völlig unterschiedliche Zelltypen. Außen liegt eine einzelne Zellschicht, das Trophektoderm, aus dem ein Teil der Plazenta hervorgeht und das für die Nährstoffversorgung des sich entwickelnden Embryos zuständig ist. Im Inneren der Höhle befindet sich, am Rand der äußeren Zellschicht, ein Zellhaufen, auch innere Zellmasse genannt. Aus dieser bildet sich letztendlich die Maus.
Wie aber entstehen die ersten Unterschiede
zwischen den Zellen? Entwickelt jede Zelle ihr Programm zufällig oder ist das
Schicksal vorherbestimmt, schon bevor man es "mit dem Auge" erfassen kann?
Untersuchungen an Fruchtfliegen, Krallenfröschen und Zebrafischen haben gezeigt,
dass spezifische Faktoren in bestimmten Regionen innerhalb der Eizelle
entscheiden, wie sich die Zellen entwickeln, die sich während den ersten
Teilungen bilden. In diesen Organismen gibt es demzufolge eine sehr frühe
Ausrichtung der Zellen im Embryo. Diese Vorab-Strukturierung klang so
verlockend, dass Wissenschaftler versuchten, diese Art von Musterbildung in der
Maus als Modell für Säugetiere zu finden.
Die Zellen im frühen
Mausembryo organisieren sich spontan
Jens-Erik Dietrich und Takashi
Hiiragi haben in ihrer Studie die Expressionsmuster von drei Faktoren (Oct4,
Cdx2 und Nanog) untersucht. Diese sind im 8-Zell Stadium noch in allen Zellen zu
finden. In der späten Blastozyste jedoch sind sie entweder nur in der inneren
Zellmasse (Oct4 und Nanog), oder nur außen, im Trophektoderm (Cdx2) zu finden.
Diese molekularen Fingerabdrücke haben Dietrich und Hiiragi benutzt, um den
Mechanismus zu beobachten, durch den die Zellen sich im Embryo organisieren.
Auffällig war ein extrem variables Muster der Expressionslevel einiger
der Faktoren (Nanog und Cdx2). Manche Zellen hatten viel, andere sehr wenig.
Überraschend war die Willkürlichkeit der Variabilität. Weder die Position im
frühen Embryo, noch eine gegenseitige Korrelation bestimmten das Muster. Um der
Sache auf den Grund zu gehen, untersuchten Dietrich und Hiiragi, ob diese
Prozesse in isolierten embryonalen Zellen genauso verlaufen wie im Embryo.
Hierzu ließen Dietrich und Hiiragi einzelne Zellen aus dem 8-Zell-Stadium ein-
oder zweimal teilen. Die Zellen produzierten entweder zwei gleich große
Schwesterzellen oder zwei unterschiedliche, ein Phänomen das auf sogenannter
symmetrischer bzw. asymmetrischer Zellteilung beruht. Nanog war in symmetrisch
und asymmetrisch geteilten Zellen immer in gleicher Menge vorhanden. Es befand
sich jedoch immer mehr Cdx2 in der größeren Zelle. Nach zwei Zellteilungen
organisierten sich die entstandenen vier Zellen zu Mini-Blastozysten, in denen
die Zellen, die außen lagen immer mehr Cdx2 hatten, als die im Inneren. "Hieraus
schließen wir, dass die Art der Zellteilung das Cdx2 Niveau der Zellen
reguliert, und dass das Proteinmuster dann bestimmt, wohin die Zelle sich
bewegt", sagt Dietrich. Besonders interessant war für Dietrich und Hiiragi aber
die Beobachtung, dass die Anzahl der Zellen eines Embryos, die eine
asymmetrische Teilung durchlaufen, sehr variabel ist. "Anscheinend ist diese
Variabilität in der Art der Zellteilung für die Blastozystenbildung unerheblich;
die Musterbildungs-Prozesse sind so flexibel in ihrer Regulation, dass sich am
Ende trotzdem immer eine Blastozyste bildet, die eben für die Einnistung
erforderlich ist."
Diese Ergebnisse sprechen gegen die Annahme, dass jede Eizelle eine "Blaupause" für die weitere Entwicklung trägt. Dietrich und Hiiragi haben gezeigt, dass das molekulare Profil in den Zellen nach dem Zufallsprinzip etabliert wird. Danach wandern die Zellen dahin, wo ihr Programm sie diktiert. Aller Anfang scheint also zufällig. Dietrich fügt hinzu: "Zufall lässt sich aber schwer beweisen." Deswegen werden Dietrich und Hiiragi die Zellen weiter unter die Lupe nehmen, um ihr vorgeschlagenes Zwei-Phasen-Modell zu bekräftigen.
Quelle: Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V.






