Proteine leuchten rot, wenn sie zusammenarbeiten
Archivmeldung vom 12.08.2006
Bitte beachten Sie, dass die Meldung den Stand der Dinge zum Zeitpunkt ihrer Veröffentlichung am 12.08.2006 wiedergibt. Eventuelle in der Zwischenzeit veränderte Sachverhalte bleiben daher unberücksichtigt.
Freigeschaltet durch Thorsten Schmitt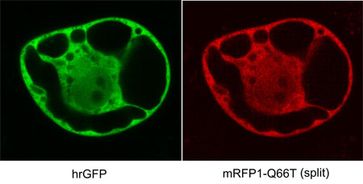
Das Leben in einer Zelle beruht auf dem Zusammenspiel von Proteinen, Genen und kleineren Molekülen. Biologen nennen solch ein Geflecht aus biochemischen Interaktionen ein molekulares Netzwerk. Biologen vom Max-Planck-Institut für Züchtungsforschung und von der Universität zu Köln beobachten jetzt live und in Farbe, welche Eiweiße eine Aufgabe gemeinsam erledigen.
Sie haben ein rot fluoreszierendes Protein (RFP) in zwei Teile getrennt, die sie an Proteine heften können. Treten die beiden Proteine miteinander in Wechselwirkung, verbinden sich auch die beiden Hälften des RFP. Das leuchtet anschließend rot - und zwar fünfzehn Mal heller als zuvor, weil die Kölner Biologen das ursprüngliche Protein biochemisch optimiert haben. Dieser Farbstoff hilft den Wissenschaftlern, die Verknüpfungen in dem molekularen Netzwerk zu untersuchen. (Nature Methods, 21. Juli 2006).
Mit der Genomforschung haben sich Biologen in den vergangenen
Jahren einen guten Überblick verschafft, mit welchen Genen und Proteinen
einzelne Organismen arbeiten. Doch diese Inventarliste reicht noch nicht, um die
Prozesse in den Zellen zu verstehen. Denn meistens arbeiten viele Gene und
Proteine zusammen, um eine bestimmte Aufgabe zu erfüllen. Zell- und
Molekularbiologen möchten nun herausfinden, welche Biomoleküle wann und wie
kooperieren.
Wissenschaftler vom Kölner Max-Planck-Institut für
Züchtungsforschung und der Universität zu Köln haben jetzt ein weiteres Werkzeug
entwickelt, mit dem sie Proteine bei der Zusammenarbeit beobachten können. Die
Wissenschaftler um Guido Jach und Joachim Uhrig haben ein verbessertes rot
fluoreszierendes Protein (RFP oder in der vollständigen Bezeichnung mRFP1-Q66T)
in zwei Teile zerlegt, die einzeln nicht fluoreszieren. Die beiden Hälften
finden in einer Zelle auch nicht spontan zueinander, sondern nur wenn sie nahe
beieinander festgehalten werden. Etwa, wenn beide an Proteinen hängen, die
miteinander interagieren. Dann schließen sich die beiden RFP-Hälften zusammen
und leuchten rot. Die rote Fluoreszenz, die ohne die Zellen zu zerstören im
Lichtmikroskop beobachtet werden kann, zeigt den Biologen also an, dass zwei
entsprechend präparierte Proteine miteinander wechselwirken.
Biologen
erforschen die Prozesse in Zellen schon seit einiger Zeit mit fluoreszierenden
Proteinen, die sich an andere Proteine hängen lassen und farbig leuchten, wenn
sie mit geeignetem Licht angeregt werden. Die neu entwickelte Methode können sie
nun mit Systemen kombinieren, die Proteininteraktionen durch gelbes, grünes oder
blaues Leuchten nachweisen. Daher können sie in einer Zelle gleichzeitig
verfolgen, ob und wie mehrere verschiedene Proteine miteinander in Kontakt
treten.
Quelle: Pressemitteilung Max-Planck-Institut für Züchtungsforschung





