Warum Fische im Eismeer nicht einfrieren: RUB-Chemiker entlarven natürlichen Frostschutz
Archivmeldung vom 23.08.2010
Bitte beachten Sie, dass die Meldung den Stand der Dinge zum Zeitpunkt ihrer Veröffentlichung am 23.08.2010 wiedergibt. Eventuelle in der Zwischenzeit veränderte Sachverhalte bleiben daher unberücksichtigt.
Freigeschaltet durch Thorsten Schmitt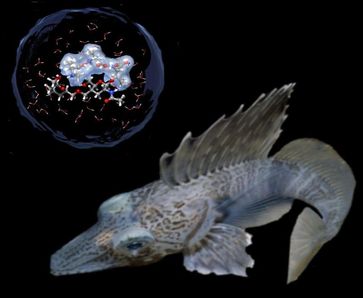
Bochumer Forscher haben herausgefunden, wie der natürliche Frostschutz funktioniert, der Fische im Eismeer vor dem Erfrieren schützt. Sie konnten beobachten, dass ein Gefrierschutzprotein im Fischblut die Wassermoleküle in seiner Umgebung so verändert, dass ein Ausfrieren unmöglich wird und das Ganze flüssig bleibt. Dabei besteht zwischen Protein und Wasser keine chemische Bindung – die Anwesenheit des Proteins genügt.
Gemeinsam mit Kooperationspartnern aus den USA beschreiben die Forscher um Prof. Dr. Martina Havenith-Newen (Physikalische Chemie II der RUB) ihre Entdeckung in einer sog. Rapid Communication in der renommiertesten amerikanischen Chemiezeitschrift, dem Journal of the American Chemical Society (JACS). Die unabhängigen Gutachter des Journals werteten die Arbeit als eine der besten 5% aller Einsendungen.
Besser als haushaltsübliche Frostschutzmittel
Bei Temperaturen von minus 1,8° C müsste eigentlich jeder Fisch erstarren: Der Gefrierpunkt für Fischblut liegt bei ungefähr minus 0,9° C. Warum antarktische Fische bei diesen Temperaturen trotzdem beweglich bleiben, interessiert die Forschung seit langem. Schon vor 50 Jahren wurden besondere Gefrierschutzproteine im Blut dieser Fische entdeckt. Diese sog. Anti-Freeze-Proteine funktionieren besser als jedes haushaltsübliche Frostschutzmittel. Wie sie aber funktionieren, war bislang noch ungeklärt. Die Bochumer Forscher setzten ihre Spezialität ein, die Terahertz-Spektroskopie. Mit Hilfe von Terahertz-Strahlung lassen sich die kollektiven Bewegungen von Wassermolekülen und Proteinen beobachten. So konnte die Arbeitsgruppe schon zeigen, dass Wassermoleküle, die in flüssigem Wasser normalerweise einen ständigen Tanz aufführen und dabei immer neue Bindungen untereinander eingehen, in Anwesenheit von Proteinen geordneter tanzen – „aus dem Discotanz wird ein Menuett“, schildert Prof. Havenith-Newen.
Mitbringsel einer Antarktis-Expedition
Gegenstand der aktuellen Untersuchungen waren Anti-Freeze-Glycoproteine des antarktischen Seehechts Dissostichus mawsoni, den einer der amerikanischen Kooperationspartner, Arthur L Devries, eigens auf einer Antarktis-Expedition gefischt hatte. „Wir konnten sehen, dass das Protein einen besonders weitreichenden Einfluss auf die Wassermoleküle in seiner Umgebung hat, wir sprechen von einer erweiterten Hydrathülle“, erklärt Mitautor Konrad Meister. „Dieser Einfluss, der die Eiskristallisation verhindert, ist bei tiefen Temperaturen sogar ausgeprägter als bei Zimmertemperatur“, setzt Prof. Havenith-Newen hinzu. Um das Wasser dennoch zum Gefrieren zu bringen, wären tiefere Temperaturen nötig. Wenn man das Protein durch einen speziellen Boratpuffer deaktiviert, funktioniert der Gefrierschutz nicht mehr. In diesem Fall fanden die Forscher auch keine Änderung des Terahertz-Tanzes. Mit ihrer Beobachtung entkräfteten die Forscher die bisherige Annahme, dass eine einzige Bindungsstelle zwischen Anti-Freeze-Protein und Wasser für die Aktivität des Proteins verantwortlich ist. Mit der Untersuchung gelang zum ersten Mal der Nachweis eines direkten Zusammenhangs zwischen der Funktion eines Proteins und seiner Signatur im Terahertz-Bereich. Die Untersuchungen wurden von der VolkswagenStiftung gefördert.
Quelle: Ruhr-Universität Bochum





